- Termofísica
- /
- Termodinámica
- /
- Segunda ley de la termodinámica.
"La máquina perfecta (movimiento perpetuo), que reutilizariam indefinidamente la energía generada por su propio movimiento, es inalcanzable."
Segunda Ley de la Termodinámica
Todos los procedimientos conocidos que se producen en la naturaleza, ya sea mecánicos, eléctricos, químicos, o biológicos obedecem las leyes de la termodinámica. Estas son muy importantes para la ingeniería, sobre todo para la construción de máquinas, y como estas generan y utilizan la energia. En este contexto las siguientes definiciones son importantes:
- Equilibrio termodinámico
- Es cuando un sistema está en equilibrio térmico, mecánico, químico y radiactivo. En este caso, no hay intercambio de materia o energía entre el sistema y el entorno, no hay cambios de fase y no hay potencial eléctricos desequilibrando el sistema.
- Procesos reversibles
- Un proceso será reversible si un sistema pasa de un estado inicial de equilibrio para un estado final de equilibrio a través de una sucesión de estado de quilibiro termodinámico. Si un proceso real es muy lento (quase-estático), es decir, tan lentamente que cada paso tiene sólo una diferencia muy pequeña (infinitesimal) en relación a la etapa de equilibrio anterior, el proceso se puede considerar reversible. De lo contrario, el proceso es llamado irreversible.
- Procesos espontáneos
- Existen procesos espontáneos y no espontáneos. Por ejemplo, el calor pasa espontáneamente del cuerpo caliente al más frío, dos gases en un mismo recipiente se mezclan espontáneamente. Sin embargo, no son procesos espontáneos cuando es necesario realizar un trabajo para que ocurran, como es el caso cuando queremos mover el calor de un cuerpo frío a uno más caliente, o para separar una mezcla de gases.
- Máquinas térmicas
- Son dispositivos que convierten la energía térmica en otras formas de energía. Ejemplos de motores térmicos son: Motor de vapor (antigua), los motores alternativos de vapor (pistón, como trenes a vapor), motores de combustión (diesel y Otto), reacción máquinas (motores a reacción y armas de fuego) y etc. . Las máquinas térmicas utilizan un mecanismo, en el cual retiran calor de un fuente caliente e parte de esa cantidad de calor es efectivamente utilizada en la realización de trabajo, el restante del calor es dirigido hacia una fuente fria (véase la figura). Así tenemos que: $$ W = Q_q - Q_f.$$
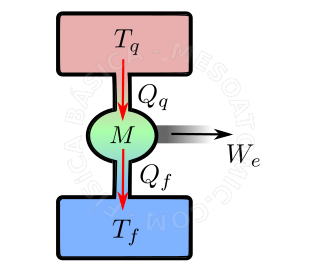
Diagrama de una maquina térmica. Una sustancia, generalmente un gas, se calienta por la fuente caliente (rectángulo rojo), a continuación, esta sustancia realiza un trabajo externo \(W_e\) (bola verde), que puede ser por ejemplo levantar un peso. Después la sustancia se enfría y se comprimime (rectángulo azul). En seguida se calienta y asi el ciclo comienza de nuevo. - Rendimiento
- El rendimiento \(\eta\) de una máquina térmica es la relación entre el trabajo realizado y la cantidad de calor eliminado en la fuente caliente: $$\eta = \frac{W}{Q_q}= \frac{Q_q – Q_f}{Q_q} = 1 - \frac{Q_f}{Q_q}.$$
Enunciados de la segunda ley y consecuencias
Vamos a presentar la segunda ley de tres maneras diferentes, porque consideramos que cada enunciado declaración realza un aspecto importante.
- Enunciado de la Eficiencia (Kelvin)
- Ningún proceso es posible cuyo único resultado es la conversión completa de calor en trabajo.
- Declaración de la irreversibilidad (Clausius)
- Ningún proceso es posible cuyo único resultado es la transferencia de calor desde un cuerpo caliente a otro más caliente.
- Declaración de la entropía
- Todos los procesos naturales evolucionan en la dirección que conduce al aumento de la entropía. (En términos simples, la entropía se puede definir como la medida de desorden de las partículas de un sistema.)
- Máxima eficiencia (máquina de Carnot)
- La máquina de Carnot es un máquina térmica teórica de rendimiento máximo. Es decir, ninguna máquina térmica que opera entre dos fuentes puede ser más eficiente que esta máquina operando entre los mismos reservatorios térmicos. La eficiencia del ciclo de Carnot es: $$ \eta_c = 1 - \frac{T_f}{T_q},$$ donde \(T_f\) y \(T_q\) son las temperaturas de las fuentes frías y calientes, respectivamente, Kelvin.
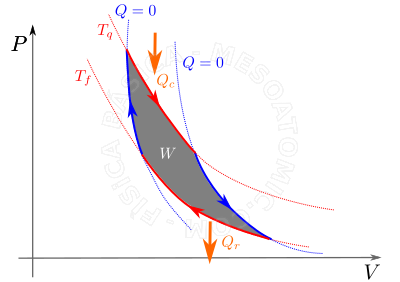
Ciclo de Carnot. Primro ocurre una expansión isotérmica reversible (línea roja superior), donde la fuente caliente da una cantidad de calor \(Q_c\) al sistema. Despues hay una expansión adiabática reversible (línea azul a la derecha), y el sistema no intercambia calor con las fuentes térmicas. A continuación, una compresión isotérmica reversible (inferior línea roja) se produce, y el sistema libera una cantidad de calor \(Q_r\) para la fuente fría. Finalmente, hay una compresión adiabática reversible (línea azul desde la izquierda), en el que el sistema no intercambia calor con las fuentes térmicas. - Refrigerador de Carnot.
- Los refrigeradores son máquinas de refrigeración que transfieren el calor ( \(Q_f\) ) de un sistema de menor temperatura (congelador) para el medio ambiente externo que está a una temperatura más alta \((Q_q)\). Este pasaje no es espontánea, y se produce a expensas de un trabajo (W) externo (trabajo del congelador). El coeficiente de performance \(K_p\) se define como: $$K_p = \frac{∣Q_f∣}{|W∣} = \frac{∣Q_f∣}{∣Q_q∣ - ∣Q_f∣}$$
- Entropía y la segunda ley
- La entropía \(S\) , así como la presión, el volumen y otras cantidades, es una característica de un sistema en equilibrio. La segunda ley de la termodinámica establece que "en cualquier proceso termodinámico que evoluciona desde un estado de equilibrio a otro, la entropía de todo el sistema+entorno permanece constante o aumenta." La variación de entropía que sufre un sistema en un proceso real (irreversible) entre dos estados de equilibrio es igual a la variación de entropía en un proceso reversible entre los mismos estados.
- El cálculo de la variación de entropía en un proceso isotérmico.
- $$\Delta S = \frac{\Delta Q}{T}$$
- $$U(S) = \frac{J}{K} ~~(SI)$$
- \(\Delta Q\) = Cantidad de calor intercambiado por el sistema con el exterior.
- \(T\) = temperatura a la que se produce este cambio.
- La variación de entropía de un sistema es positivo cuando la cantidad de calor \(\Delta Q\) es positivo, es decir, cuando el sistema recibe calor, y negativo cuando el sistema proporciona calor.
- $$U(S) = \frac{J}{K} ~~(SI)$$
- Variación de entropía en un proceso adiabático reversible.
- $$\Delta S = 0$$
- Entropía y la energía libre.
- Macroscópicamente la entropía es una cantidad que está relacionada con la energía libre del sistema o utilizable do sistema. Un aumento de entropía produce una disminución de la energía utilizable. Microscópicamente, la entropía está relacionada con "desorden". En los procesos naturales, los sistemas tienden a evolucionar espontáneamente a un estado de mayor desorden. Por ejemplo, dos gases separados en un recipiente (orden), tienden a mezclar de forma espontánea (desorden). La restauración del orden sólo es posible mediante la realización de un trabajo. Se asocia a la función de entropía al concepto de desordenn, de tal forma que el valor da función aumenta quanto aumenta el desorden nos procesos naturales.
Más alla de la segunda ley
Todavía tenemos otra ley de la termodinámica.
- La tercera ley
- Es imposible para un sistema de alcanzar el cero absoluto, a través de un número finito de operaciones. Algunas consecuencias de la tercera ley de la termodinámica: en el cero absoluto, la capacidad térmica y el coeficiente de dilatación de los cuerpos se convierten en cero.
