- Termofísica
- /
- Calor
- /
- Transiciones de fase
"Sólido, líquido o gas? Sustancia, temperatura y presión?"
Transiciones de fase
Las sustancias pueden estar en tres estados físicos: sólido, líquido o gaseoso, ver fig. 
Para que se produce un cambio de fase, es necesario para proporcionar (o retirar) una cantidad de calor \(Q\) de la sustancia. Durante el cambio de fase, la energía recibida (o cedida) se utiliza para cambiar la organización de las moléculas, y en este momento no hay una variación de la temperatura.
Las definiciones más importantes son:- Sustancia pura
- Es cualquier materia cuya fusión y ebullición ocurren a temperatura constante, también es llamada simplemente de sustancia.
- Calor latente de la transición de fase \((L)\)
- Es la cantidad de calor \(L\) necesaria para cambiar la fase por unidad de masa de una sustancia de interés. Es decir, para un sistema de masa \(m\) que se encuentre en la temperatura de cambio de fase y a una presión constante, la energía necesaria para que el sistema cambie de fase será: $$Q = L \times m.$$
- Energía interna
- Cuando una sustancia pasa del estado sólido para el líquido, del estado líquido para el gaseoso, o del sólido para el gaseoso, la energía interna del cuerpo aumenta, incluso cuando la temperatura no varia. Durante las transformaciones inversas de las transformaciones citadas anteriormente, la energía interna del cuerpo disminuye.
Diagrama de fases
Las diferentes fases y sus coexistencias pueden visualizarse mejor en un diagrama de \(P \times T\) , véase la figura a continuación. 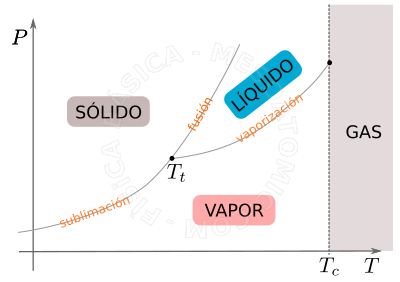
- Punto triplo
- Es el único punto en el que todos los estados pueden coexistir en equilibrio de fase, para un valor determinado de temperatura ( \(T_t\) ) y de presión específica.
- La temperatura crítica \((T_c)\)
- Por encima de la temperatura crítica no se puede licuificar una sustancia por simple compresión isotérmica, por mas alta que sea la presión, es decir, por encima de la temperatura crítica la sustancia es llamada de gas.
- Evaporación
- Es el fenómeno de la transición de las moléculas del líquido para gas. Para las moléculas que se encuentran en la interfaz líquido-gas es importante tener en cuenta que:
- La evaporación es un fenómeno que ocurre a cualquier temperatura;
- Cuanto mayor sea la temperatura mayor será la tasa neta de evaporación;
- Cuando hay flujo de aire (viento) sobre la superficie aumenta la tasa de evaporación;
- La velocidad de evaporación de un líquido depende del area de la superficie del líquido.
- Un vapor en equilibrio con su líquido, a una temperatura, dada ejerce presión máxima de vapor (PMV).
CALOR LATENTE DE TRANSFORMACIÓN FUSIÓN EBULLICIÓN Sustancia Punto Calor Punto Calor \(SI\) K KJ / kg K KJ / kg Hidrógeno 14.0 58.0 20.3 455 Mercurio 234 11.4 630 296 Agua 273 333 373 2256 Plomo 601 23.2 2017 858 Plata 1235 105 2323 2336 Cobre 1356 207 2868 4730
Leyes de la fusión y solidificación
La fusión y solidificación de una sustancia pura dependen sólo de la presión y la naturaleza de la sustancia. Es decir, si la sustancia es pura y la presión en esta es constante, entonces \(T_{fusão} = a\) y \(T_{solidificação} = b,\) donde \(a\) y \(b\) son constantes.
Durante la fusión, o solidificación, la sustancia presenta una variación de volumen.
Agua
El agua es uno de los elementos fundamentales para la vida tal como la conocemos, y entender sus propiedades es crucial.-
Calor latente Valor (cal / g) Fusión ( \(L_F\) ) 80 Solidificación ( \(L_S\) ) -80 Vaporización ( \(L_V\) ) 540 Condensación ( \(L_C\) ) -540 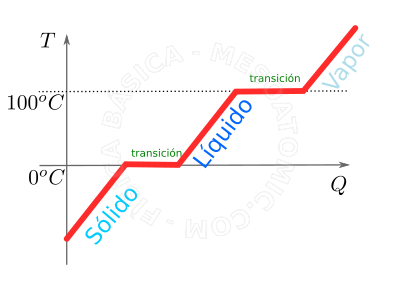
Curva de calentamiento del agua bajo una presión de 1 atmósfera. Esta figura describe las diferentes fases que el agua pasa al ser calentada, es decir, conforme va recibiendo calor. Inicialmente, a una temperatura suficientemente baja, el agua está en su forma sólida, es decir, en forma de hielo. Conforme este recibe calor, su temperatura se eleva hasta que alcanza los \(0^oC\). Cuando el hielo alcanza \(0^oC\), mismo que continúa recibiendo calor, su temperatura todavía no aumenta, pero se lleva a cabo un cambio de fase. En este momento, el calor recibido servirá para transformar el hielo a líquido y no a aumentar la temperatura (esto se ilustra por la primera meseta en la figura). Una vez que todo el hielo se volvió líquido a \(0^oC\), al recibir más calor, de nuevo la temperatura del sistema crecerá hasta alcanzar \(100^oC\), en donde se produce nuevamente una transición de fase. La referencia de la escala de Kelvin
La temperatura del punto triple es una referencia ideal para las escalas de temperatura, siendo necesarias condicones muy específicas de presión y temperatura para llegar a este punto, esto proporciona un punto de referencia que se traduce en una escala más precisa. Por lo tanto, la escala Kelvin se define como una escala lineal de la temperatura que comienza en \(0K\) , el cero absoluto, y pasa a través de \(273,16K\) en el punto triple del agua.
